LINK:http://es.wikipedia.org/wiki/Per%C3%B3xido
Peróxido

Los peróxidos son sustancias que presentan un enlace oxígeno-oxígeno y que contienen el oxígeno en estado de oxidación −1. La fórmula general de los peróxidos es Metal + (O-1)2-2. Generalmente se comportan como sustancias oxidantes.
En contacto con material combustible pueden provocar incendios o incluso explosiones. Sin embargo, frente a oxidantes fuertes como elpermanganato, pueden actuar como reductor oxidándose a oxígeno elemental. Es importante puntualizar que el peróxido tiene carga.
En pocas palabras, son óxidos que presentan mayor cantidad de oxígeno que un óxido normal y en su estructura manifiestan un enlace covalente sencillo apolar entre oxígeno y oxígeno.
Síntesis

El peróxido más conocido y principal compuesto de partida en la síntesis de otros peróxidos es el peróxido de hidrógeno (H2O2). Hoy en día se suele obtener por autooxidación de naftohidroquinona. Antiguamente se utilizaba la formación de peróxido de bario o la hidrólisis de persulfatos que a su vez se generaban por electrólisis de sulfatos en disolución acuosa con altas densidades de corriente por superficie del electrodo.
Muchas sustancias orgánicas pueden convertirse en hidroperóxidos en reacciones de autooxidación en presencia de luz y oxígeno atmosférico. Especialmente peligroso es la formación a partir de éteres ya que estos se transforman muy fácilmente y los peróxidos se suelen enriquecer en el residuo de una posterior destilación. Allí pueden producir explosiones muy fuertes. Muchos de los accidentes más trágicos de laboratorio se deben a este tipo de reacción. Por lo tanto antes de destilar cantidades mayores de estos disolventes hay que probar la presencia de peróxidos con papel impregnado de yoduro de potasio y almidón. La formación de un color azulado u oscuro indica la presencia de peróxido. (El peróxido oxida el yoduro a yodo elemental que, a su vez, forma con el almidón un complejo de inclusión del color característico oscuro).
Presencia
Los peróxidos se forman en pequeñas dosis en muchos procesos de oxidación vegetal. Para evitar su acumulación a concentraciones dañinas los organismos suelen disponer de una enzima, la catalasa, que cataliza la dismutación del peróxido de hidrógeno en agua y oxígeno elemental.
Usos
Parámetro de análisis en la industria alimentaria
En la industria alimentaria se utiliza como parámetro para medir la calidad de los aceites y las grasas, los cuales son susceptibles de enranciarse o descomponerse, mediante la técnica de medición del índice de peróxido (o índice e peroxidación); siendo la peroxidación una de las causas que provoca características rechazables en la calidad de los alimentos (tales como aceites, entre otros).
Aplicaciones químicas

Igualmente las aplicaciones de los peróxidos son muy versátiles (Pasan de la peluquería donde se emplean en tintes para aclarar el pelo hasta en combustibles de cohetes.)
En la industria química se utilizan en la obtención de los epóxidos, en diversas reacciones de oxidación, como iniciadores de reacciones radicalarias por ejemplo para endurecerpoliésteres o en la fabricación del glicerol a partir del alcohol hidroxipropénico. El ácido peroxi-trifluoroacético (F3C–C(=O)–O–O–H) es un desinfectante muy potente y se emplea como tal en la industria farmacéutica. En odontología se utiliza para el blanqueamiento de los dientes, ya sea aplicado en gel o en bandas impregnadas de peróxido en concentraciones de 9%, 16% y 25%. También para la decoloración del cabello...
Estado de oxidación
El estado de oxidación del oxígeno en los grupos peróxido es -1
Analítica

Los peróxidos dan una coloración anaranjada con disoluciones de óxido de titanio en ácido sulfúrico concentrado.
Con dicromato de potasio forman el peróxido de cromo (VI) de color azul que puede ser extraído con éter etílico.
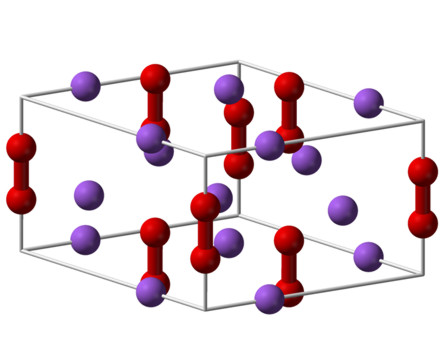
Los peróxidos consisten en combinaciones binarias del oxígeno junto a ciertos metales. Son derivados de óxidos que contienen la agrupación -O-O-, O22- llamado ión peróxido.
Formulación de los peróxidos

Los peróxidos se formulan utilizando la valencia del oxígeno -1 ya que los dos oxígenos comparten una pareja de electrones por los que en este grupo de elementos no se pueden simplificar las valencias.
La fórmula de los peróxidos es del tipo X2(O2)n (donde X es el elemento metálico, O es oxígeno y n es la valencia del elemento metálico).
Nomenclatura de los peróxidos
Nomenclatura tradicional: la nomenclatura tradicional de los peróxidos se nombra con la palabra peróxido seguida del elemento metálico teniendo en cuenta la valencia del elemento metálico. Los sufijos utilizados siguen el siguiente criterio:
- Una valencia: Peróxido ... ico
- Li+1 + O2-2 » Li2O2: peróxido lítico
- Dos valencias:
- Menor valencia: Peróxido ... oso
- Cu+1 + O2-2 » Cu2O2: peróxido cuproso
- Mayor valencia: Peróxido ... ico
- Cu+2 + O2-2 » Cu2(O2)2 » CuO2: peróxido cúprico
- Menor valencia: Peróxido ... oso
- Tres valencias:
- Menor valencia: Peróxido hipo ... oso
- Ti+2 + O2-2 » Ti2(O2)2 » Ti(O2): peróxido hipotitanioso, dejamos los paréntesis para no confundir con óxido de titanio (IV)
- Valencia intermedia: Peróxido ... oso
- Ti+3 + O2-2 » Ti2(O2)3: peróxido titanioso
- Mayor valencia: Peróxido ... ico
- Ti+4 + O2-2 » Ti2(O2)4 » Ti(O2)2: peróxido titánico
- Menor valencia: Peróxido hipo ... oso
- Cuatro valencias:
- Primera valencia (baja): Peróxido hipo ... oso
- U+3 + O2-2 » U2(O2)3: peróxido hipouranioso
- Segunda valencia: Peróxido ... oso
- U+4 + O2-2 » U2(O2)4 » U(O2)2: peróxido uranioso
- Tercera valencia: Peróxido ... ico
- U+5 + O2-2 » U2(O2)5: peróxido uránico
- Cuarta valencia (alta): Peróxido per ... ico
- U+6 + O2-2 » U2(O2)6 » U(O2)3: peróxido peruránico
- Primera valencia (baja): Peróxido hipo ... oso
Nomenclatura de stock: la nomenclatura de stock se realiza indicando el número de valencia del elemento metálico entre paréntesis y en números romanos, precedido por la expresión "peróxido de" + elemento metálico.
Ejemplo:
Cu2O2: peróxido de cobre (I)
Ti2(O2)3: peróxido de titanio (III)
Ti2(O2)3: peróxido de titanio (III)
En el caso de aquellos elementos metálicos que sólo actúan con una valencia no es necesario indicarla.
Ejemplo:
Li2O2: peróxido de litio en lugar de peróxido de litio (I)
Nomenclatura sistemática: en esta nomenclatura se indica mediante prefijos numéricos seguidos de la expresión óxido + el prefijo correspondiente junto al elemento metálico.
Ejemplos:
Li2O2: peróxido de dilitio
Ti2(O2)3: triperóxido de dititanio
Ti(O2): peróxido de titanio, no se indica el prefijo mono cuando sólo existe un átomo del elemento metálico.
Ti2(O2)3: triperóxido de dititanio
Ti(O2): peróxido de titanio, no se indica el prefijo mono cuando sólo existe un átomo del elemento metálico.


No hay comentarios:
Publicar un comentario